Výzkumníci Caltech podporují desetiletí starý model importu mitochondriálního proteinu

Vědci ukázali, že mnoho mitochondriálních proteinů vstupuje do organely během syntézy, vedené skládacími vzory a strukturálními signály. Tento objev reviduje desetiletí biochemických modelů.
Mitochondrie jsou organely nejčastěji známé jako „Powerhouses of Cell“, protože generují ATP (adenosin triphosfát), hlavní zdroj energie pro většinu buněčných aktivit. Pocházely před více než miliardou let, když předků archaeal buňka vytvořila symbiotické partnerství s bakterií.
Během evolučního času se mitochondrie stala nepostradatelnou pro metabolismus a produkci energie a přenášela většinu svého genetického materiálu do hostitelské buňky. Výsledkem je, že nyní závisí na hostiteli, aby vytvořili většinu svých proteinů, které jsou syntetizovány ribosomy mimo organel a musí být přesně přepravovány do mitochondrií.
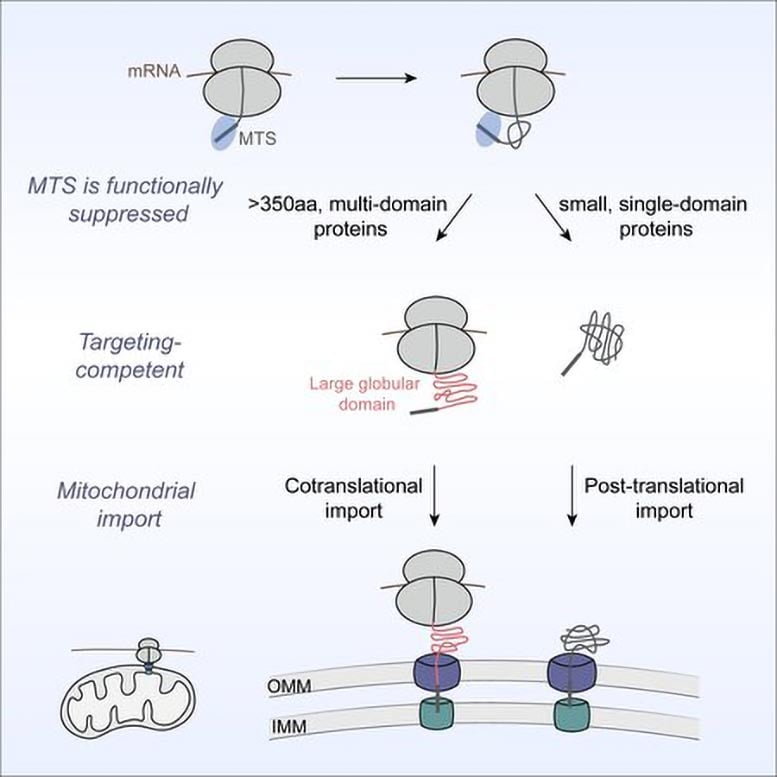
Vědci v Caltech nyní odhalili nové poznatky o tom, jak se tyto proteiny pohybují z ribosomů v cytosolu, tekutině obklopující jádro, do mitochondrií. Neočekávaně zjistili, že cesta je silně ovlivněna mechanismy skládání proteinů.
„Ukazuje se, že lokalizace proteinů do mitochondrií zahrnuje vícevrstvou komplexní cestu, která je propojena kolem biofyzikálních principů skládání proteinů,“ říká Shu-Oou Shan, profesor chemie Altair v Caltech.
Výzvu tradičního modelu
Po mnoho let byl převládajícím pohledem v biochemii, že mitochondriální proteiny jsou importovány až po překladu – proces, ve kterém ribosomy staví proteiny propojením aminokyseliny Společně podle genetického kódu – je plně dokončen. V nové studii zveřejněné v BuňkaShu-Oou Shan a její tým vyzývají tento model a uvádějí, že až 20 procent mitochondriálních proteinů je dováženo kotranslačně. Jinými slovy, tyto proteiny začínají vstupovat do mitochondrií, zatímco se stále sestavují na ribozomech.
„Jakmile jsme identifikovali tyto mitochondriální proteiny, které jsou kotranslačně importovány, zeptali jsme se:“ Co je na této podskupině proteinů zvláštní? „, Říká Zikun Zhu (PhD ’24), Shanův bývalý student a hlavní autor příspěvku.
Obtížně složitě proteiny a načasování importu
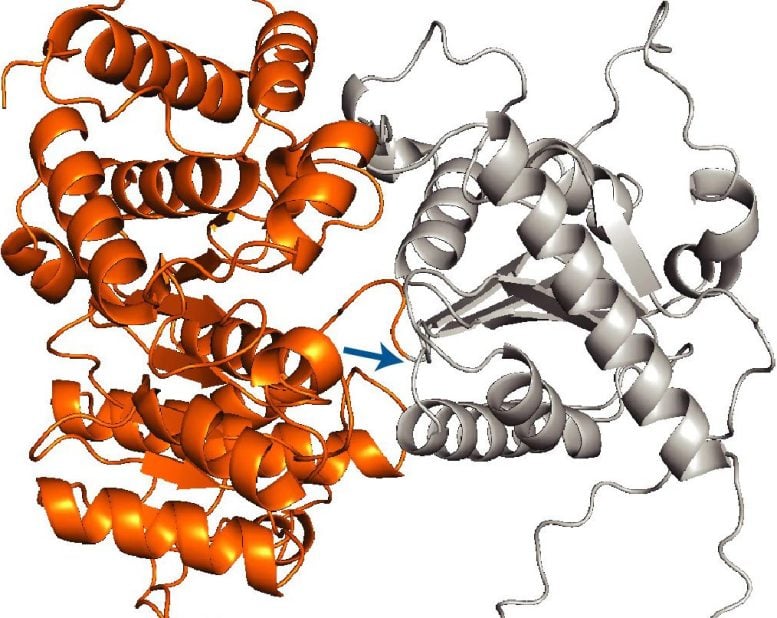
Vědci zjistili, že definující vlastnost těchto proteinů je jejich velikost a strukturální složitost. Mnoho z nich je topologicky složité, obsahující zbytky-aminokyseliny v řetězci-, které mohou být v pořadí daleko od sebe, ale musí se spojit, aby se dosáhlo správného trojrozměrného záhybu. „To se stává mnohem obtížnějším procesem, než jen skládat se prostřednictvím interakcí mezi sousedními zbytky,“ poznamenává Shan.
Výsledkem je, že systém pro kotranslační import do mitochondrií upřednostňuje tyto opravdu obtížné proteiny. To dává smysl, pokud si uvědomíte, že velké struktury musí během importu nakonec projít úzkými kanály na mitochondriální membráně. „Bude problém, pokud necháte tyto velké, velmi složité proteiny dokončit translaci v cytosolu,“ říká Shan. „Uvíznou v nevratných strukturách a pak nejen blokujete import, ale ucpáváte všechny kanály.“
Molekulární signály a sekvence cílení
Tým zjistil, že téměř všechny takové proteiny nesou sekvenci mitochondriálního cílení, což je signál, který nasměruje proteiny na mitochondrie. Přesto, překvapivě to samo o sobě nestačí říct, že tato podskupina proteinů bude dodána během překladu. Zhu provedl experimenty, které ukázaly, že systém čeká na druhý molekulární signál, aby přesunul protein do mitochondrií brzy. Tento signál přichází ve formě první velké proteinové domény nebo skládací strukturální jednotky v sekvenci, která se vynoří z ribozomu.
„Je to jako mít palubní průsmyk zamčený v kufru,“ říká Zhu. „Sekvence cílení je palubní průsmyk, ale pro přístup k němu potřebujete kód pro otevření kufru. V tomto případě je velká doména ten kód.“
Vědci byli dokonce schopni transplantovat příklady takových velkých proteinových domén na jiné mitochondriální proteiny, které jsou normálně importovány po translaci, a ukázaly, že domény skutečně sloužily jako přenositelné signály schopné přesměrovat proteiny, které mají být během translace importovány.
„Kotranslační cílení na mitochondrie se ukáže být úplně odlišné od cílení na jiné organely,“ říká Zhu. „Do budoucna bude vzrušující odhalit více mechanistických detailů a nakonec manipulovat s načasováním importu mitochondriálního proteinu. To nám nejen pomůže pochopit, proč buňky vyvinuly tak sofistikovanou cílovou cestu pro mitochondriální proteiny, ale také otevírají dveře k potenciálním terapeutickým aplikacím.“
Reference: „Principy importu kotranslačního mitochondriálního proteinu“ od Zikun Zhu, Saurav Mallik, Taylor A. Stevens, Riming Huang, Emmanuel D. Levy a Shu-Oou Shan, 11. srpna 2025,. Buňka.
Doi: 10.1016/j.cell.2025.07.021
Tato práce byla podporována Národní zdravotní ústavy Grant R35 GM136321 S.-OS a Howard Hughes Medical Institute prostřednictvím grantu Freeman Hrabowski Scholar Rebecca Voorhees. EDL uznává podporu Evropské rady pro výzkum (ERC) v rámci výzkumného a inovačního programu Horizon 2020 Evropské unie (Grantová dohoda č. 819318), organizací programu Human Frontiers Science Program (Ref. RGP0016/2022) a Izraelskou vědeckou nadací (č. 1452/18).
Nikdy nezmeškáte průlom: Připojte se k zpravodaji Scitechdaily.