Nová generace léčby Alzheimerovy choroby, vysvětlená v grafice
Tento článek je součástí „Inovace v: Alzheimerově chorobě„Redaktně nezávislá speciální zpráva, která byla vytvořena s finanční podporou Eisai.
ALzheimerova choroba se ukázala jako složitý cíl a vědci a vývojáři drog provádějí účinné léčbu po celá desetiletí. Debaty vznášejí základní příčiny poruchy a různé přístupy čelily jedné překážce za druhou. Pole však dosáhlo bodu obratu. Během posledních čtyř let schválila americká správa potravin a léčiv několik terapií, které se zabývají některými potenciálními biologickými kořeny podmínky, než pouze zmírňující příznaky – klíčový vědecký milník. Navzdory pokrokům však stále existuje dlouhý seznam otevřených otázek a tolik práce.
Mozky lidí, kteří umírají s Alzheimerovou chorobou, vykazují zřetelnou biologii: shluky nebo „plaky“ amyloidních beta proteinů v prostorech mezi neurony a spleti tau proteinů, které se hromadí primárně v nervových buňkách. Jedna převládající teorie tvrdí, že se amyloid staví brzy a tauové se vyvíjejí, když probíhá poškození nervových buněk, ale kognitivní příznaky dosud nejsou zřejmé. V průběhu času tyto patogenní nebo způsobující onemocnění proteiny narušují komunikaci o nervových buňkách. Nejnovější ošetření – Lecanemab a Donanemab – se spojují s amyloidními beta proteiny, vyčistí je z mozku a mírně pomalý kognitivní pokles.
O podpoře vědecké žurnalistiky
Pokud se vám tento článek líbí, zvažte podporu naší oceněné žurnalistiky předplatné. Zakoupením předplatného pomáháte zajistit budoucnost působivých příběhů o objevech a myšlenkách, které dnes formují náš svět.
Progrese z proteinů spojených s nemocemi na skutečnou demenci je však dlouhá a nepřesná a proteiny amyloidů a tau se však hromadí u lidí s jinými neurodegenerativními poruchami. U Alzheimerovy choroby je často 20- až 30leté zpoždění mezi počáteční detekcí amyloidu a zjevným kognitivním poklesem. Podle jedné studie, která předpovídala riziko onemocnění na základě demografických údajů, úmrtnosti a amyloidního stavu, se méně než jedna čtvrtina kognitivně zdravých 75letých žen, které pozitivně testují na amyloid při analýze míchy nebo polosmické emise (PET) mozkové skenování během jejich životnosti. Taková zjištění naznačují, že samotný amyloid nevede progresi onemocnění a podnítil vědce, aby prozkoumali jiné strategie.
Analýzy sekvence DNA identifikovaly genové varianty, které ovlivňují Alzheimerovo riziko. Některé z těchto genů poukazují na kritickou roli imunitní aktivity a zánětu v procesu onemocnění. Jiný výzkum ukazuje, že jedním ze způsobů, jak snížit riziko onemocnění, jsou změny životního stylu. Podle zprávy 2024 by mohla být zabráněna nebo zpožděna téměř polovinou případů demence na celém světě činy, které se zabývají 14 modifikovatelnými rizikovými faktory, včetně ztráty sluchu, fyzické nečinnosti a vaskulárních rizikových faktorů, jako je diabetes a kouření (z nichž mnohé také ovlivňují imunitní aktivitu a zánět).
Základy
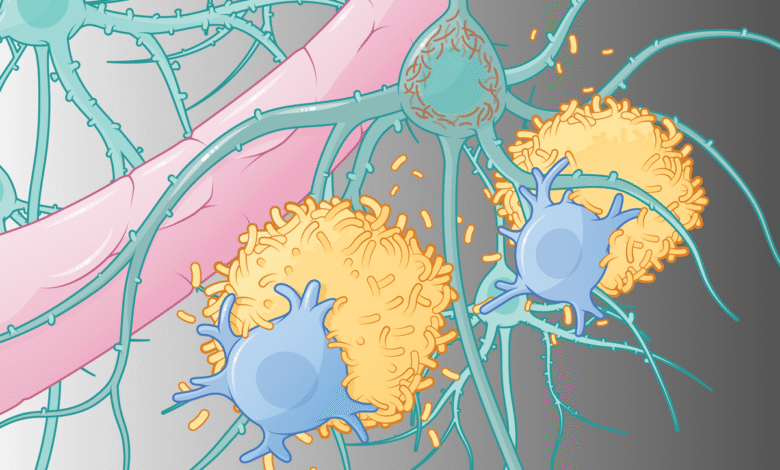
Známým charakteristickým znakem Alzheimerovy choroby je nahromadění proteinů Tau (A) a amyloidní beta (B) v mozku. V průběhu času plaky a spleti způsobují poškození neuronů (C) a buněčnou smrt. Většina pacientů s Alzheimerovou chorobou však také nashromáždila jiné proteiny, jako je alfa-synuklein, jakož i poškození krevních cév, které se může objevit před amyloidními plaky. Nedávné důkazy naznačují, že zánět, imunitní procesy a vaskulární rizikové faktory také hrají klíčovou roli v nemoci.
Cíle léčby
Existuje více než 100 probíhajících klinických studií, které testují řadu intervencí, z nichž každý se zaměřuje na jednoho nebo více potenciálních přispěvatelů k demenci. „Dostaneme se tam ve fázích,“ říká Sudha Seshadri, neurologka a zakládající ředitelka Glenn Biggs Institute for Alzheimerovy a neurodegenerativní choroby v UT Health San Antonio v Texasu. „Léčba snižující amyloidy je kusem. Imunitní modulující léky budou pravděpodobně kusem,“ říká. Dodává také důležité kontrolovat cévní riziko, což „je důležité bez ohledu na to, co se ještě děje“.
Zde uvedené mechanismy jsou považovány za klíčové prvky rizika Alzheimera:
Neurotransmiterové receptory • • Proteiny na površích nervových buněk, které přijímají signály a hrají rozhodující roli v paměti a učení. Některé léky pro Alzheimerovu blok škodlivou aktivitu v těchto receptorech a jiné zvyšují aktivitu tím, že zabrání rozpadu neurotransmiterů.
Amyloid • • Protein, který, když je chybně složen, se může v mozku hromadit mimo nervové buňky a vytvářet plaky, které narušují nervovou funkci. Cílem několika terapií je rozpustit tyto usazeniny.
Zánět a imunitní procesy • • Ty mohou být aktivovány nahromaděním abnormálních forem amyloidu a tau v mozku, což vede k poškození nervových buněk a kognitivní pokles.
Získat • • Protein, který obvykle pomáhá udržovat strukturu a tvar buňky. Může se nahromadit v neuronech a tvořit spleti, které jsou charakteristickým znakem Alzheimerovy choroby, amyloidní plaky. Některé nové terapie se pokoušejí zacílit na patologické formy TAU, zabránit agregaci těchto proteinů a zvýšit jejich clearance.
Synaptická plasticita a neuroprotekce • • Způsoby, jak mozek modifikuje spojení mezi neurony během učení a paměti a chrání neurony před poškozením. Oba procesy mohou být narušeny u lidí s Alzheimerovou chorobou.
Metabolismus • • Proces, kterým mozek rozkládá živiny. U pacientů s Alzheimerovou chorobou vykazují skenování PET abnormálně nízký metabolismus glukózy v oblastech mozku důležitých pro paměť a poznání. Cílem některých terapií je zvýšit metabolismus glukózy, který mozek potřebuje energii.
Vaskulatura • • Specializované krevní cévy v mozku tvoří dynamické rozhraní známé jako hematoencefalická bariéra, která pomáhá dodávat živiny do nervových buněk a chránit mozek před patogeny. Rozklad této bariéry bylo spojeno s více neurodegenerativními chorobami, včetně Alzheimerovy choroby.
Růstové faktory a hormony • • Proteiny, které mohou chránit mozkové buňky před poškozením a stimulovat produkci nových buněk. Cílem některých terapií je doplnit a poskytnout další vrstvu ochrany.
Epigenetické regulátory • • Proteiny a další molekuly, které zapínají nebo vypnou gen bez změny základní sekvence DNA. Přitom mohou ovlivnit akumulaci špatně složeného amyloidu, špatně složeného tau nebo jiných patogenních proteinů.
Neurogeneze • • Neurální růst. Poškozené nervové buňky mohou přispět k poškození paměti a kognitivního poklesu u lidí s Alzheimerovou chorobou. Podpora růstu nových nervových buněk by mohla tento pokles pomoci zpomalit.
Oxidační stres • • Nezdravá nadměrná množství volných radikálů vzhledem k antioxidantům v těle, které mohou poškodit nervové buňky a narušit jejich funkci. Cílem některých terapií je zmírnit oxidační poškození zvýšením aktivity specifických enzymů, které neutralizují volné radikály.
Proteóza • • Proces, který udržuje správné skládání, syntézu a degradaci proteinu v buňkách a může být narušen u lidí s Alzheimerovou chorobou. Některé experimentální intervence podporují buněčné dráhy, které zabraňují nesprávnému proteinu nebo které usnadňují jejich odstranění.
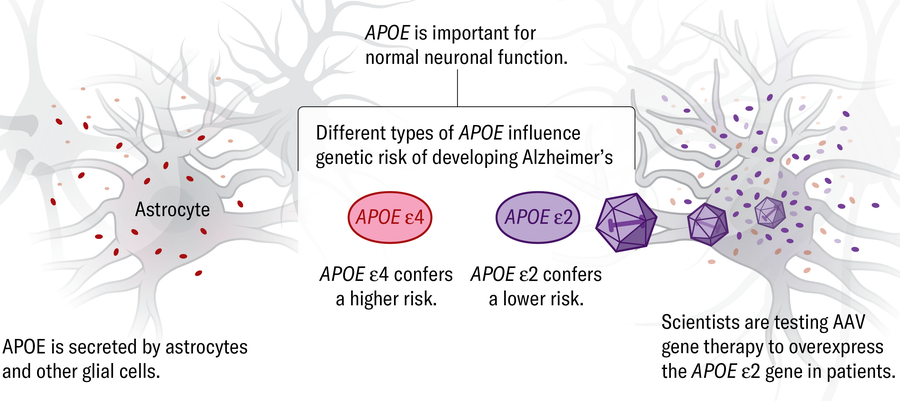
Apoe • • Zkratka pro apolipoprotein E, gen kódující protein, který má tři hlavní formy: ε2, ε3 a ε4. Apoe ε4 je nejsilnějším genetickým rizikovým faktorem pro Alzheimerovu chorobu. Lidé mají dvě kopie nebo alely Apoe. Mít jeden Apoe E4 alela může zvýšit celoživotní riziko někoho až čtyřnásobně oproti riziku lidí se dvěma kopiemi nejběžnější varianty, Apoe ε3; dva Apoe E4 alely mohou zvýšit riziko až 25krát. Lidé se dvěma Apoe ε3 alely mají o 40 procent vyšší pravděpodobnost, že se vyvinou Alzheimerovy choroby než ty s jedním ε3 a jedním ε2.
Řada lékových přístupů
Tento graf zahrnuje 138 léčiv v 182 klinických studiích – farmakologické Alzheimerovy studie registrované s ClinicalTrials.gov Od ledna 2025. Ačkoli to není komplexní (například nejsou zahrnuty všechny pokusy založené mimo USA), datový soubor poskytuje užitečný pohled na velké obrany. (Poznámka editora: Zkoušky se nezahrnují také zkoušky na cvičení, životní styl nebo pečovatelské zásahy, kognitivní behaviorální terapie, doplňky, lékařské potraviny nebo terapie kmenových buněk.) Pokusy jsou seskupeny podle sdíleného mechanismu účinku na levé (cíle léčby) a terapeutických cílů napravo. Výsečové grafy ukazují, jaké procento každé kategorie léčiv je ve studiích fáze 1, 2 a fáze 3. (Léky ve studiích fáze 3 jsou obecně blíže ke schválení FDA než fáze 1.) Neurotransmiterové receptory, amyloid a zánět jsou v současné době nejčastěji cílenými mechanismy. Nejoblíbenější terapeutickou kategorií jsou léky zaměřené na onemocnění-v tom, že cílem je zpomalit klinický pokles zaměřením na molekuly a tělesné systémy. Naproti tomu léky zaměřené na symptomy zaměřují na rozdíl od zlepšení měřitelných příznaků, které jsou již na začátku léčby přítomny.
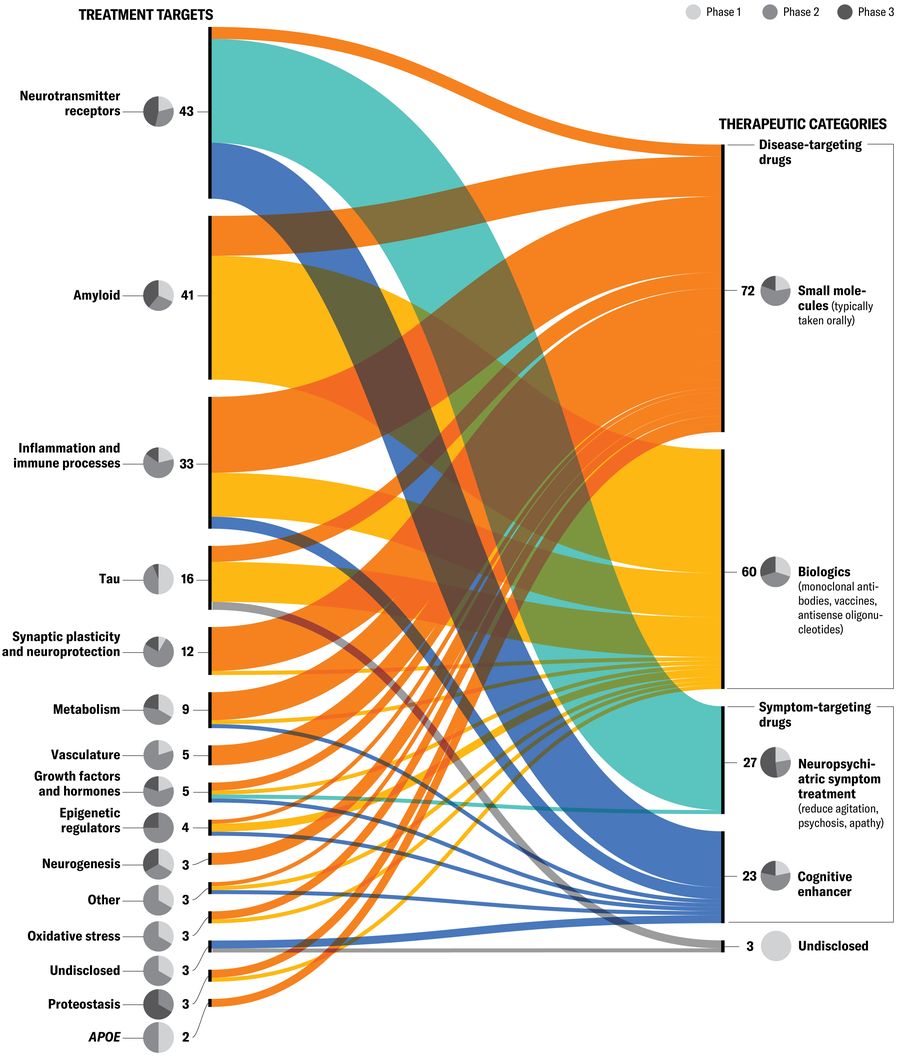
Jen Christiansen Zdroj: „Alzheimerova choroba Development Development Pipeline: 2025“, Jeffrey L. Cummings et al., In In Alzheimerova a demence: translační výzkum a klinické intervenceVol. 11; Duben – červen 2025 (data)
Intervenční případové studie
Zatímco léky, které se zaměřují na proteiny amyloid a tau, získaly velkou pozornost a financování, jiné terapeutické přístupy se zaměřily na další biologické mechanismy u Alzheimerovy choroby. Příklady druhé skupiny jsou popsány níže.
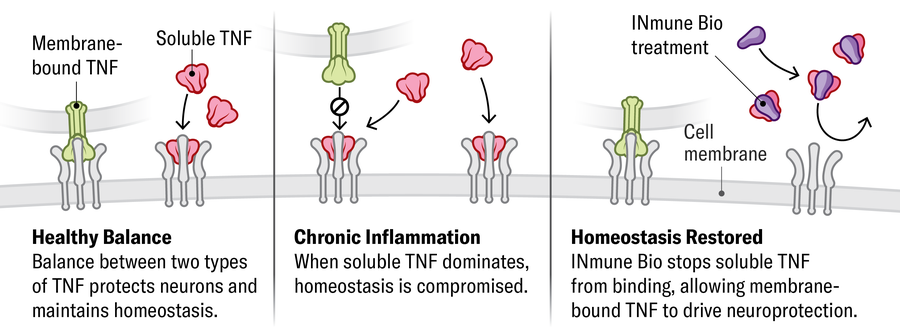
Zánět • • Udržování zdravých nervových buněk a jejich ochranu před poškozením vyžaduje rovnováhu mezi rozpustnými a membránovými formami proteinu zvaného TNF-a. V podmínkách imunitní dysfunkce narušuje nárůst rozpustné TNF-a zdravou rovnováhu nebo homeostázu a zvyšuje zánět. Jedna společnost (Inmune Bio) vyvíjí lék, který váže a deaktivuje rozpustné TNF-a a obnovuje účinky transmembránové formy podporující zdraví.
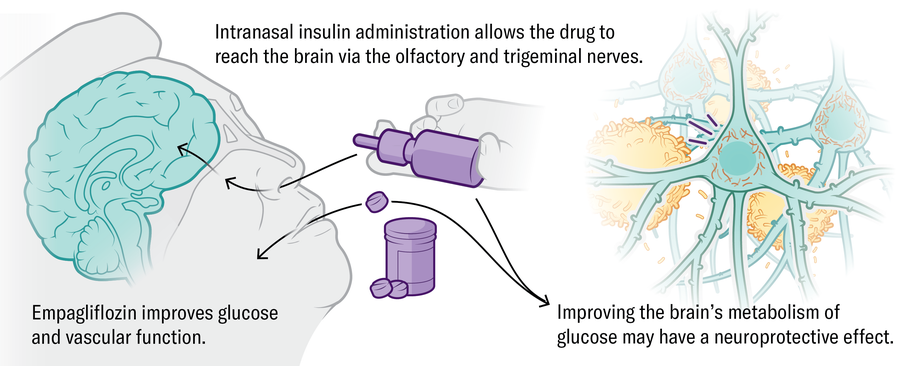
Metabolismus • • Inzulín, hormon, který reguluje dostupnost energie a komunikaci mozkových buněk, také pomáhá udržovat imunitní a cévní zdraví. Klinická hodnocení vedená Suzanne Craft z lékařské fakulty Wake Forest University University School of Medicine testuje intranazální dodávku inzulínu a diabetes Drug Empagliflozin u lidí s časným Alzheimerovým nebo mírným kognitivním poškozením.
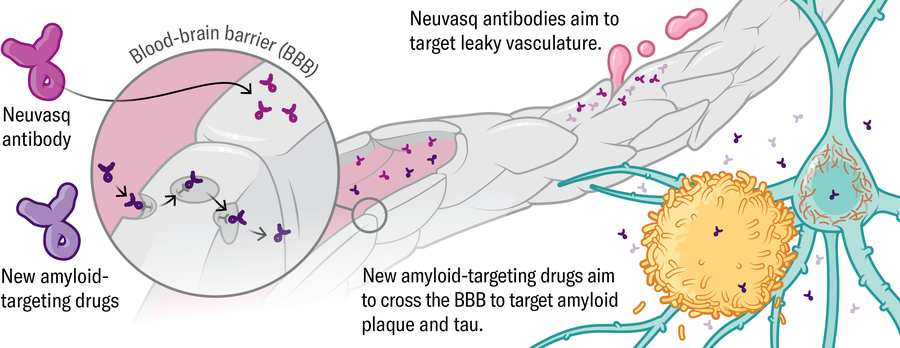
Vaskulatura • • Několik společností vyvíjí nové verze amyloidních protilátek, které mohou mozku proniknout efektivněji – například Rocheův trontinemab. Alespoň jedna společnost, Neuvasq, vyvíjí dřívější intervenci, která se zaměřuje na samotnou vaskulaturu, aby testovala, zda méně netěsná bariéra krve-křemene může zpomalit progresi onemocnění.
Apoe • • Cílem některých terapeutických strategií se snížit nebo se zbavit Apoe ε4 varianta rizika, zvýšení produkce proteinů pomocí ochranného genu, Apoe ε2 nebo upravit Apoe ε4 gen do Apoe ε2 verze. Ve studii malé genové terapie použila terapeutika Lexeo modifikovaná viry k dodání Apoe ε2 gen do míchy 15 pacientů s Alzheimerovým chorobou, kteří měli nebezpečnější Apoe ε4 varianta.