Použití bakteriofágů k boji proti antimikrobiální rezistenci
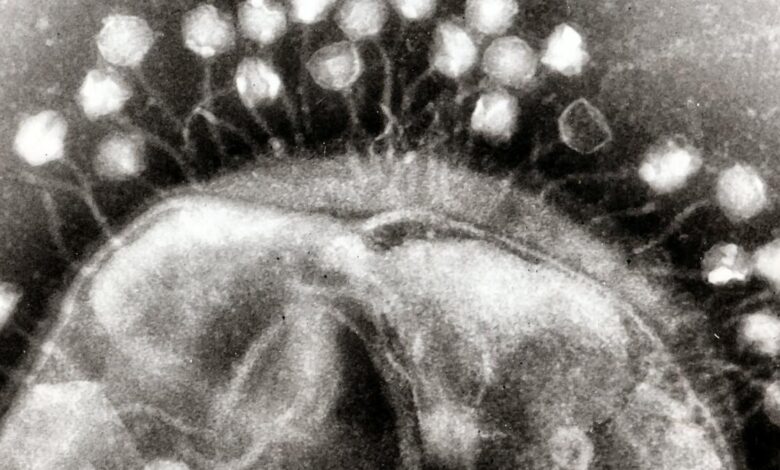
Transmisní elektronový mikrograf více bakteriofágů připojených k bakteriální buněčné stěně. | Foto kredit: Graham Beards (CC by-SA)
Pokud má například infekci močových cest, patologická laboratoř identifikuje bakterii, řekněme, Vykazovali chill. Určuje také citlivost patogenu na více než tucet antibiotik. Je v pořádku, pokud je bakterie citlivá na mnoho nebo všechny léky. Scénář noční můry je, když je vůči všem odolný.
Antibiotika stále více nefungují, protože bakterie se vyvinuly rezistence. Odhaduje se, že globálně asi pět milionů lidí umírá podmínky související s antimikrobiální rezistencí (AMR) každý rok. To se může zdvojnásobit do roku 2050. Je to tichá pandemie.
Jaké je řešení? Farmaceutické společnosti z velké části ztratily zájem o rozvoj nových antibiotik. Zatímco lék na rakovinu se používá po dlouhou dobu, antibiotika jsou podávána po dobu několika dnů. Také kvůli problému AMR se nová antibiotika používají co nejvíce, aby se zabránilo rozvoji odporu. Neexistuje proto, aby společnosti neexistovaly žádné finanční pobídky k práci na nových antibiotikách. Dochází k určitému vývoji léčiv, ale pravděpodobně nestačí k řešení problému AMR.

Bakteriofágy jsou „dobré viry“, které přirozeně kořistí bakterie. Jsou všude kolem nás, ve vodě, ve půdě, v našem střevě, na naší kůži atd. Předpokládá se, že na Zemi je 10krát tolik fágů jako bakterie.
Fágy se začaly používat proti bakteriálním infekcím asi před stoletím, ale antibiotika je nahradila, jakmile byly objeveny. Na rozdíl od antibiotika, které může být schopno zabít mnoho druhů bakterií, mohou fágy zabít pouze několik kmenů konkrétní bakterie. Proto je nadále používaly pouze země v sovětském bloku, odříznuté od antibiotik. Institut v Gruzii v Tbilisi, s více než 100 lety zkušeností, je známý svými fágovými odbornostmi. Vzhledem k AMR nyní zbytek světa znovu objevuje fágy a v mnoha zemích probíhá relevantní výzkum.
Fágy byly použity pro popáleniny, vředy nohou, infekce střev, respirační infekce, infekce močových cest atd. Existují dvě hlavní strategie, které byly použity. Jeden, izolujte bakterie z infikované tkáně, zkontrolujte, který fág proti ní pracuje v laboratoři, růst více tohoto fágu a podávat jej pacientovi. Tyto fágy mohou pocházet z fágové banky vlastní nebo ve velmi vážných případech, kdy se může pomoci také fágové banky jinde na světě o pomoc. To jsou přirozené fágy. Pak existují geneticky upravené fágy, které byly v laboratoři upraveny tak, aby rozšířily rozmanitost bakterií, které mohou zabít.
Pokud jsou jako léky používány fágy, mají jedinečnou vlastnost. Bakterie se mohou vyvíjet jako rezistentní vůči antibiotiku; Stejně tak se bakterie mohou vyvíjet tak, aby byly odolné vůči fágu. Jedinečná část je, že také fágy se mohou vyvinout, aby se zabránilo bakteriální rezistenci. Lék není konstantní, ale vyvíjející se entita. To je proto pro regulační orgány bolesti hlavy, protože nikdy nebyla schválena žádný lék, který by se vyvíjel. Dále, protože fágy jsou velmi specifické pro bakterie, jeden fág nebude fungovat proti velké frakci, řekněme, vředů nohou, jak se to děje u antibiotika (dokud nebudeme muset zvážit AMR). Je tedy také náročné provádět randomizované kontrolované studie, pokud se může lék potřebný pro každého pacienta lišit.
Svět je zoufalý pro nové způsoby léčby pro AMR. Doposud žádná vláda v západním světě neschválila fág jako lék. Mohou však pacientům umožnit přístup k fágům ve formě „soucitného používání“, „trasy„ speciálního přístupu “s využitím nouze“. Toto jsou často schválení pro jednotlivé, pojmenované pacienty, kteří zoufale potřebují. Další trasou, která se například používá v Belgii, je „magistrální trasa“, kde konkrétní lékárny mohou „složit“ fág speciálně pro konkrétního pacienta.
Regulační bolest hlavy může být vyřešena, pokud zkoumá následující scénář, který Jean-Paul Pirnay a kolegové v Belgii zkoumá. Vytvořte zařízení, ve kterém lze provést všechny následující kroky: Izolujte bakterie od infekce, sekvence jeho genomu, pomocí AI k určení, který fágový genom je nejpravděpodobnější, že bude fungovat, vytvoří fág od nuly v zařízení a podávejte jej pacientovi na místě.
V takovém scénáři by fág nebyl regulován jako lék. Místo toho by bylo zařízení regulováno. A zařízení by obsahovalo pouze rutinně používané molekuly, jako jsou nukleotidy a enzymy, které by se použily k sestavení fágu.
Rozsah AMR je takový, že potřebujeme mnoho velkých iniciativ, abychom se pokusili řešit. Pokud skupina mikrobiologů hledá velkou výzvu, která používá AI, jistě stojí Prirnay trasa, kterou stojí za prozkoumání?
Gayatri Saberwal je konzultantem v Tata Institute for Genetics and Society.
Publikováno – 8. června 2025 05:30
