3D Struktura lidského klastru vrhá světlo na rizikový faktor Alzheimera
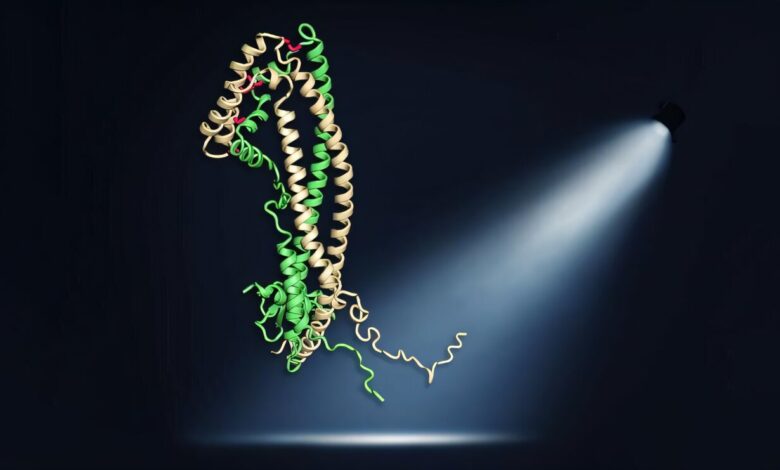
Protein klastru je zobrazen jako tzv. Model pásu. Flexibilní peptidové ocasy mají důležitou ochrannou funkci, která byla v této publikaci poprvé prokázána. Kredit: Andreas Bracher, MPI biochemie
Alzheimerova choroba (zátěže) z pozdního nástupu je nejčastější formou demence, přičemž příznaky se objevují po věku 65 let. Vzhledem k tomu, že nosiče alel rizika klastrinu mají zvýšenou pravděpodobnost rozvoje zátěže, je pro vědce zajímavý přidružený protein klastrinu. Abychom lépe porozuměli funkci přidruženého proteinu, vědci v Max Planck Institute of Biochemistry dešifrovali molekulární základ pro funkci chaperonu clusterinu.
Vědci byli poprvé schopni určit krystalografickou trojrozměrnou strukturu lidského klasterinu a zjistili, že dva narušené, hydrofobní peptidové ocasy jsou zásadní pro rozmanité vazby a ochranné funkce clusterinu. Zjištění nyní byla Publikováno v časopise Strukturální a molekulární biologie přírody.
Struktura klastru: klíčový protein proti neurodegenerativním onemocněním
Tým vedený Patricií Yuste-Checa, Andreas Bracher a F.-Ulrich Hartl, ředitel a vedoucí oddělení buněčné biochemie, nyní poprvé použili rentgenovou krystalografii k objasnění trojrozměrné krystalové struktury lidského klasterinu. Vědět, jak jsou atomy uspořádány v proteinu, umožňuje vyvodit závěry ohledně jeho obecného způsobu účinku a funkce chaperonu.
Studie ukazuje, že klastru je složen ze tří různých domén. Obzvláště zajímavé jsou dva narušené hydrofobní peptidové ocasy, které dávají proteinu jeho pozoruhodnou všestrannost. Yuste-Checa, první autor studie, vysvětluje: „Struktura peptidových ocasů je srovnatelná se strukturou proteinů malých tepelných šoků. Molekulární chaperony které zabraňují proteinu shlukování uvnitř buněk, zatímco klastru funguje mimo buňky. “
Proteiny splňují širokou škálu funkcí v buňkách a musí být přesně složeny, aby tak učinily. Nesprávné skládání může vést k tvorbě škodlivých agregátů – typické charakteristiky mnoha neurodegenerativních onemocnění, jako jsou Alzheimerovy nebo Parkinsonovy.
Molekulární chaperony, jako je clusterin, hrají ústřední roli při prevenci takového nesprávného složení. Klusterin, také známý jako apolipoprotein J, je známý od 80. let jako hojně vylučovaný glykoprotein. Až dosud však nedošlo k podrobnému pochopení molekulárního fungování tohoto všestranného ochranného proteinu.

Funkční přiřazení strukturálních prvků CLU. Kredit: Strukturální a molekulární biologie přírody (2025). Dva: 10.1038/S41594-025-01631-4
Ochrana před agregací proteinů
„Clusterin působí v extracelulární prostor: váže se na špatně složené proteiny, včetně agregačních produktů amyloidní beta, tau a a-synukleinu, které jsou typické pro nemoci, jako jsou Alzheimerovy nebo Parkinsonovy, a brání jim další agregace, “státy Yuste-Checa.
„Ve studii jsme byli schopni ukázat, že hydrofobní, tj. Vodopěrné, peptidové ocasy s klasterinu jsou nezbytné pro ochrannou funkci. Poté, co jsme měli biotechnologicky modifikovanou nebo odstraněny hydrofobní aminokyseliny v peptidových ocasu, jsme ztratili chaperonovou aktivitu, tj. Ochranou funkci proti amyloidní agregaci.“ Vazba na Receptory buněčného povrchu a tvorba komplexů lipoproteinů se také zdá být zprostředkována peptidovými ocasy.
Význam pro medicínu
Nové poznatky o struktuře a funkci clusterinu jsou lékařsky relevantní. Andreas Bracher říká: „Pro klasterin bylo prokázáno mnoho funkcí, zpočátku jako faktor agregace buněk, později jako apolipoprotein, inhibitor komplementového systému, molekulárního chaperonu a antiapoptotického faktoru.
„Je známo, že clusterin váže extracelulární amyloidní beta plaky a že hladiny klastrinu v mozkomíšním moku jsou zvýšeny u Alzheimerovy choroby. Dešifrování struktury a mechanismu klasterinu nám dává nový vhled do extracelulárních mechanismů proteinu a bude to užitečné pro klinický výzkum a budoucnost o budoucnosti a budoucnost je pro klinický výzkum a budoucnost bude užitečná pro klinický výzkum a budoucnost o budoucnosti a budoucnost o budoucnosti a budoucnost poskytuje do budoucna a budoucnost o budoucnosti a budoucnost. Neurodegenerativní onemocnění“
Více informací:
Patricia Yuste-Checa a kol., Strukturální analýzy definují molekulární základ funkce shlukovacího chaperonu, Strukturální a molekulární biologie přírody (2025). Dva: 10.1038/S41594-025-01631-4
Poskytl Max Planck Institute for Biochemistry
Citace: 3D Struktura lidského klastru vrhá světlo na rizikový faktor Alzheimera (2025, 5. září) načteno 6. září 2025 z https://medicalxpress.com/news/2025-09-3d-husterin-alzheimer-factor.html
Tento dokument podléhá autorským právům. Kromě jakéhokoli spravedlivého jednání za účelem soukromého studia nebo výzkumu nemůže být žádná část bez písemného povolení reprodukována. Obsah je poskytován pouze pro informační účely.




