Izolované střevní mikrobce řídí silnější reakce na terapii rakoviny
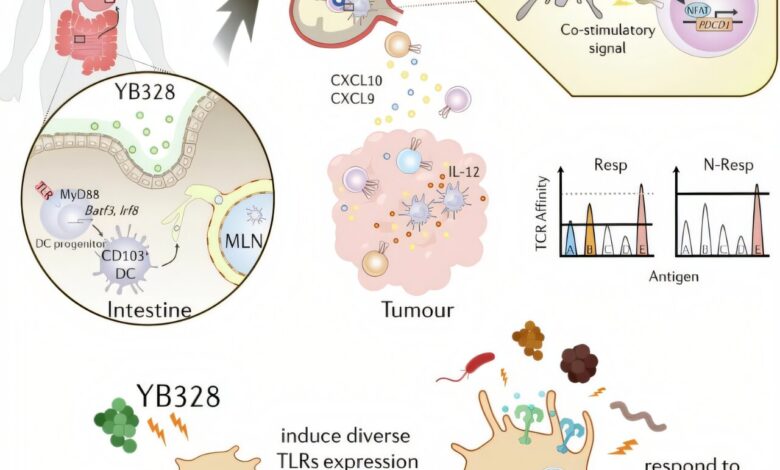
Grafické souhrny mechanismu, kterým střevní mikrobiota zvyšuje protinádovou účinnost blokádové terapie PD-1. Kredit: Příroda (2025). Dva: 10.1038/S41586-025-09249-8
Národní výzkumný ústav Cancer Center v Tokiu uvádí, že nově izolovaná střevní bakterie, označená kmenem homineromicrobium YB328, mobilizuje specializované dendritické buňky, aby posílila dopad imunoterapie blokády PD-1 napříč několika typy nádorů.
Pacienti nesoucí tento kmen v jejich střevech vykazovali robustnější infiltraci aktivovaných T buněk v nádorech a po imunitní léčbě zažili delší přežití bez progrese.
Terapie blokády imunitního kontrolního bodu, včetně Monoklonální protilátky Zacílení na PD-1 a PD-L1 se staly standardními možnostmi pro mnoho typů rakoviny a vedly k významnému zlepšení přežití bez progrese a celkového přežití.
V střevní mikrobiotahojnost bakterií, jako je ruminococcus spp. a Prevotellaceae spp. byl dříve spojen s klinickou účinností blokádových terapií imunitního kontrolního bodu, zatímco jiné taxony prokázaly vazby na kratší přežití bez progrese.
Bylo navrženo několik mechanismů pro vysvětlení toho, jak střevní mikroby tyto účinky vyvíjejí, včetně stimulace makrofágů a monocytů, antigenní mimikry mezi mikrobiotou a nádorovými antigeny a přímé aktivace CD8 infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru infiltrace nádoru+ T buňky pomocí metabolitů odvozených od mikrobioty.
Prediktivní biomarkery schopné identifikovat pacienty s největší pravděpodobností reagovat, zůstávají vzácné, což ponechává naléhavou potřebu nových strategií k rozšíření dopadu imunoterapie.
Ve studii „Mikrobiota řízená protinádorová imunita zprostředkovaná migrací dendritických buněk“, “ Publikováno v PřírodaVědci izolovali dříve nepopsaný bakteriální kmen, aby zkoumali, zda jeho přítomnost zvyšuje protinádorovou účinnost blokádové terapie PD-1.
Vzorky stolice byly prospektivně odebrány od 50 japonských pacientů, z toho 15 jedinců s rakovina plic nemasových buněk a 35 s rakovinou žaludku, všechny léčené blokádou PD-1.
Vědci provedli amplikonové sekvenování genu 16S rRNA na fekálních vzorcích, aby vyhodnotili bakteriální složení a použili analýzu charakteristické charakteristiky přijímače, analýzu citlivosti/specificity, k vyhodnocení prediktivních biomarkerů. Hlavní souřadnicová analýza a analýza podobností měřila rozdíly v mikrobiotě mezi respondenty a nereagujícími.
Vědci nejprve zjistili, že členové rodiny ruminococcaceae byli významně obohaceni u respondentů a korelovali s prodlouženým přežitím bez progrese. Kmen YB328 byl izolován ze stolice pacientů, kteří reagovali na terapii, následoval sekvenování metagenomu a kvantifikaci na úrovni druhu pomocí Kraken2 a Bracken.
Myši ošetřené antibiotiky a myší ošetřené antibiotiky byly kolonizovány transplantací fekální mikrobioty a monitorovány na růst nádoru po léčbě monoklonální protilátky anti-PD-1.
Pacienti s vysokou hojností YB328 ve fekálních vzorcích vykazovali významně delší přežití bez progrese a zvýšenou infiltraci CD103+ CD11b– konvenční dendritické buňky u nádorů napříč řadou typů rakoviny.
YB328 izolované z předchozích vzorků fekálních respondentů zvětšily protinádorovou účinnost léčby blokády PD-1 v myším modelu.
Samostatné analýzy ukázaly, že myši kolonizované s YB328 prokázaly zvýšenou hojnost aktivovaného CD8+ T buňky, CD8 produkující cytokin+ T buňky a rozmanitý repertoár receptoru T buněk v lymfocytech infiltrujících nádor.
Ve studiích in vitro vykazovaly dendritické buňky ošetřené YB328 vyšší expresi CD86, CD80, hlavních molekul třídy I histokompatibility a další ko-stimulační markery. Tento fenotyp dendritických buněk odpovídal zvýšené indukci exprese PD-1 a rozšířenou reaktivitou CD8+ T buňky proti nádorovým antigenům.
Podávání jiného mikrobu, P. vulgatus, bylo spojeno s kratším Přežití bez progrese u pacientů a snížená akumulace PD-1+ CD8+ T buňky v nádorech myší. Další experimenty prokázaly, že společné podávání P. vulgatus zrušilo protinádorové účinky pozorované pouze při léčbě YB328.
Na rozdíl od předchozích zpráv se hojnost rodů Faecalibacterium, Enterococcus, Bifidobacterium a Akkermansia významně nelišila mezi respondenty a neodpovídajícími.
Vědci dospěli k závěru, že kolonizace YB328 podporuje diferenciaci a migraci CD103+ CD11b– konvenční dendritické buňky, které aktivují CD8 infiltrující nádor+ T buňky a zvyšují účinnost blokádových terapií PD-1.
Autoři navrhují, aby se zaměření na střevní mikrobiotu mohly vytvořit nové přístupy ke zlepšení výsledků imunoterapie u pacientů s různými typy rakoviny.
Napsal pro vás náš autor Justin Jacksoneditoval Sadie Harleya skutečnost zkontrolovali a přezkoumali Andrew Zinin– Tento článek je výsledkem pečlivé lidské práce. Spoléháme se na čtenáře, jako jste vy, aby udrželi nezávislou vědeckou žurnalistiku naživu. Pokud vám toto hlášení záleží, zvažte a dar (zejména měsíčně). Dostanete bez reklamy účet jako poděkování.
Více informací:
Nina Yi-Tzu Lin a kol., Mikrobiota řízená protinádorová imunita zprostředkovaná migrací dendritických buněk, Příroda (2025). Dva: 10.1038/S41586-025-09249-8
© 2025 Science X Network
Citace: Izolované střevní mikrobce řídí silnější reakce na terapii rakoviny (2025, 16. července) získané 16. července 2025 z https://medicalxpress.com/news/2025-07-isolated-gut-microbe-rengonses.html
Tento dokument podléhá autorským právům. Kromě jakéhokoli spravedlivého jednání za účelem soukromého studia nebo výzkumu nemůže být žádná část bez písemného povolení reprodukována. Obsah je poskytován pouze pro informační účely.




