Mutace přináší žhavé nové stopy pro léčbu imunitních „studených“ nádorů
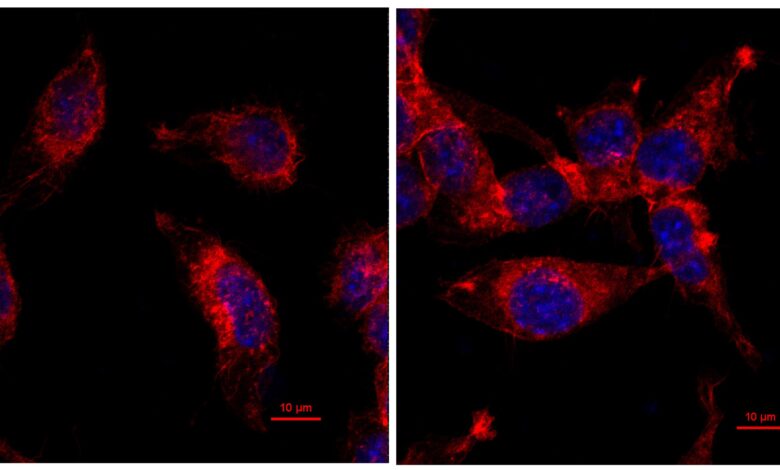
Tyto snímky z konfokálního mikroskopu zobrazují rozdíly v proliferaci buněk mezi normálním myším nádorem rakoviny tlustého střeva (vlevo) a nádorem nesoucím mutaci A159V, která vede k rychlejšímu růstu nádoru. Nový výzkum od odborníků z Cincinnati Children’s odhaluje, že lék rapamycin může způsobit, že mutované nádory budou citlivější na inhibitory imunitního kontrolního bodu. Kredit: Cincinnati Children’s
Inhibitory imunitního kontrolního bodu (ICI) se objevily v USA asi před 15 lety jako vzrušující třída léčby rakoviny, která dosáhla úplných a trvalých remisí u tisíců lidí s konečným stádiem metastatického karcinomu. Nicméně mnoho dalších pacientů má nádory, které zůstávají „studené“ a nereagují na tyto léčby.
Nyní vědci z Cincinnati Children’s objevili konkrétní genová mutace číhající za tímto nedostatkem odezvy – a na myších modelech odhalují, že dobře známý lék rapamycin způsobuje, že takové „studené“ nádory opět reagují.
výzkum, zveřejněno v Vědecké pokrokyvedl první autor Mingjun Cai, postgraduální student z oddělení vývojové biologie; odpovídající autor Yi Zheng, Ph.D.; a tým vědců z oddělení experimentální hematologie a biologie rakoviny.
„Pokud další výzkum potvrdí tento účinek u lidí, mohou tato zjištění usnadnit stratifikaci pacientů s touto genovou mutací, kteří mohou mít prospěch z kombinované formy léčby,“ říká Zheng. „Těšíme se na pokračování této práce.“
Výzkumný tým zjistil, že specifická mutace genu RAC1 (označeného A159V) vede k rychlejšímu růstu několika druhů rakovinných nádorů, včetně rakoviny tlustého střeva, plic, hlavy a krku a melanomu. Tato mutace vytváří imunosupresivum nádor mikroprostředí (označované jako TIME), které blokuje účinnost ICI.
Tým prokázal, že mutované nádory vykazují sníženou infiltraci imunitních buněk a narušenou komunikaci mezi nádorovými a imunitními buňkami. Je pozoruhodné, že mutace aktivuje signalizaci mTORC1, což zvyšuje spotřebu glukózy v nádoru a zároveň zbavuje imunitní buňky energie, kterou potřebují k boji s nádory. Mutace také potlačuje produkci chemokinů a downreguluje expresi IFNGR1, čímž dále chrání nádory před imunitním útokem.
Silnou zprávou v této studii je, že vědci již vědí, že lék schválený FDA – rapamycin – inhibuje signalizaci mTORC1. Když byl navíc k ICI poskytnut rapamycin, mutantní nádory se ve většině případů staly stejně citlivé na léčbu jako nemutované nádory.
Potenciální podpora pro třídu léčby rakoviny
Koncept ICI vychází ze schopnosti rakovinných nádorových buněk vyhýbat se útokům přirozené obranyschopnosti těla. Nádory to dělají pomocí imunitních „kontrolních bodů“ k deaktivaci reakcí imunitního systému. Zvrácení tohoto procesu, je-li úspěšné, činí nádory zranitelnými.
Prvním inhibitorem imunitního kontrolního bodu schváleným pro použití ve Spojených státech byl ipilimumab (značka Yervoy) v roce 2011. Tento blokátor CTLA-4 byl původně schválen pro léčbu metastatického melanomu. Od té doby bylo schváleno několik dalších inhibitorů kontrolních bodů pro různé typy rakoviny.
Vědci tvrdí, že nalezená genová mutace A159V se pravděpodobně vyskytuje pouze u malé části lidí s imunitními „studenými“ nádory; zatím není jasné kolik.
„Důležité je, že ačkoli tato mutace u rakoviny může být nedoceněná, zjistili jsme, že rapamycin může zvrátit tyto rezistentní účinky při nízkých dávkách,“ říká Zheng. „Tento přístup by mohl lékařům umožnit efektivněji léčit pacienty s rakovinou mutovanou A159V a zároveň snížit riziko vedlejších účinků.“
Další klinické studie jsou potřebné k ověření těchto zjištění na myších u lidských rakovin. Dokončení takových zkoušek může trvat několik let. Také rapamycin je imunosupresivní nástroj, který se častěji používá k prevenci odmítnutí transplantovaného orgánu. Zheng předpovídá, že mohou být vyvinuty další sloučeniny, které mohou přesněji inhibovat signalizaci RAC1, aby posílily schopnosti ICI bojovat proti rakovině s menšími celkovými dopady na imunitní systém.
Další informace:
Mingjun Cai et al, RAC1 odvozený z nádoruA159Vmutace podporuje imunosupresivní mikroprostředí, které potlačuje odpověď na inhibitor imunitního kontrolního bodu, Vědecké pokroky (2025). DOI: 10.1126/sciadv.aea1212
Citace: Mutace přináší žhavá nová vodítka pro léčbu imunitních „studených“ nádorů (2025, 29. října) získaná 30. října 2025 z https://medicalxpress.com/news/2025-10-mutation-yields-hot-clues-immune.html
Tento dokument podléhá autorským právům. Kromě jakéhokoli poctivého jednání za účelem soukromého studia nebo výzkumu nesmí být žádná část reprodukována bez písemného souhlasu. Obsah je poskytován pouze pro informační účely.




