přesná oprava DNA může být vodítkem pro lidské stárnutí

Pozoruhodná životnost velryby grónská a nízké riziko rakoviny pramení z jemně vyladěného systému opravy DNA poháněného unikátním proteinem CIRBP. Vědci zjistili, že tento mechanismus nejen zachovává genom velryby, ale může také zlepšit opravu DNA a stabilitu v lidských buňkách.
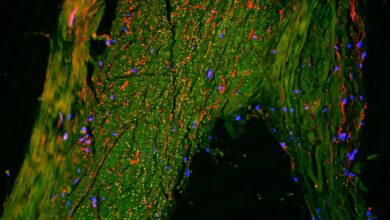
Studie: Důkaz pro zlepšenou opravu DNA u dlouhověkých velryb grónských. “Bowhead Whale Closeup“od Zprávy UW, CC BY 2.0
V nedávné studii publikované v časopise Přírodavýzkumníci předložili důkazy o zlepšené opravě DNA u velryb grónských.
Výjimečná dlouhověkost a odolnost proti rakovině u velryb obecných
Velryba grónská může žít více než 200 let a její hmotnost přesahuje 80 000 kg. Přes svou dlouhou životnost a velký počet buněk není velryba grónská příliš náchylná k rakovině, což je nesrovnalost známá jako Petův paradox. Jako takový může mít jedinečné genetické mechanismy k prevenci rakoviny a nemocí souvisejících s věkem, což umožňuje dlouhý život. Výzkum molekulárních a buněčných mechanismů, které jsou základem této dlouhověkosti u velryb grónských, je však omezený.
Genetické hity a riziko rakoviny napříč druhy
Podle vícestupňového modelu karcinogeneze zahrnuje přechod z normální do rakovinné buňky několik odlišných genetických zásahů (mutací). Delší a větší druhy mohou vyžadovat vyšší počet zásahů pro maligní transformaci, vzhledem k delší životnosti a počtu buněk. Důsledně studie ukázaly, že myší fibroblasty vyžadují dva zásahy, zatímco lidské fibroblasty vyžadují pět zásahů. Jako takové mohou mít déle žijící a větší organismy ještě více vrstev ochrany než lidé.
Molekulární a buněčný základ velrybí dlouhověkosti
V této studii vědci předložili důkazy o molekulárních a buněčných vlastnostech, které mohou být základem dlouhověkosti a odolnosti proti rakovině u velryby grónské. Většina testů byla provedena na primárních kožních fibroblastech a zobecnění na modely epiteliální rakoviny vyžaduje další zkoumání.
Telomerázová aktivita a buněčné stárnutí
Pozorovali, že kožní fibroblasty velryby grónské, stejně jako lidské fibroblasty, postrádaly telomerasovou aktivitu a vykazovaly replikativní senescenci a zkrácení telomer po sériovém pasážování. Aktivita telomerázy byla nedetekovatelná ve fibroblastech a ve většině tkání, s nízkými hladinami v kůži. Replikativnímu stárnutí bylo v lidských a velrybích fibroblastech zabráněno nadměrnou expresí lidské telomerasové reverzní transkriptázy (hTERT) k udržení délky telomer. U velrybích fibroblastů bylo po y-ozařování snadno pozorováno stárnutí vyvolané stresem. Transkriptomická analýza senescentních buněk odhalila oslabenou indukci senescenčního sekrečního fenotypu (SASP) faktory ve velrybích fibroblastech ve srovnání s lidskými buňkami.
Cesty potlačení nádorů a odolnost vůči transformaci
Velrybí fibroblasty měly nižší bazální aktivitu p53, bez zvýšení apoptotické odpovědi na genotoxický stres ve srovnání s lidskými buňkami. To kontrastuje se sloními modely, které spoléhají na zvýšenou signalizaci p53 a apoptózu pro potlačení nádoru. Dále tým zkoumal počet genetických zásahů potřebných pro onkogenní transformaci. Exprimující lidské primární fibroblasty hTERT požadovaný opičí virus (SV40) velké T antigen (SV40 LT), SV40 malý T antigen (SV40 ST) a HRas protoonkogenGTPase (HRAS HRAS) G12V mutace (HRAS HRAS (G12V)) pro maligní transformaci.
naproti tomu hTERT-exprimující velrybí fibroblasty byly transformovány pouze pomocí SV40 LT a HRAS HRAS (G12V), což naznačuje, že pro maligní transformaci stačilo méně genetických zásahů. Experimenty s myšími xenografty potvrdily tyto transformační výsledky.
Mutační frekvence a stabilita genomu
Celogenomové sekvenování lidských, myších a grónských fibroblastů odvozených z nádorových xenograftů a netransformovaných rodičovských buněk ukázalo srovnatelné relativní podíly jednonukleotidových variant (SNV). Je pozoruhodné, že velrybí nádory vykazovaly významně nižší frekvenci de novo somatických SNV a snížený počet velkých strukturních variant (např. inzerce, duplikace a delece) a malých inzerčně-delečních mutací (indels), zejména mezi strukturálními variantami > 500 kb. Testy mutageneze ukázaly nižší míru mutace ve fibroblastech velryby grónské po ošetření N-ethyl-N-nitrosomočovinou, ethylmethansulfonátem a 1-methyl-3-nitro-1-nitrosoguanidinem nebo y-ozařováním než u lidských fibroblastů. Výsledky byly u obou konzistentní SMM-seq a HPRT testy reportérů mutací a bowhead fibroblasty ukázaly vyšší bazální a poškození indukované PARP aktivita.
Srovnávací cesty opravy DNA
Dále tým pozoroval podobnou opravu nukleotidové excize (NER) aktivita mezi lidskými a velrybími fibroblasty, stejně jako nevýznamný vzestupný trend v opravě základní excize (BER) aktivita ve velrybích buňkách. Velrybí fibroblasty měly výrazně vyšší účinnost opravy nesouladu (MMR) než myší, lidský nebo kravský fibroblast. Navíc velrybí fibroblasty vykazovaly podstatně vyšší frekvenci homologní rekombinace (HR) a nehomologické spojování konců (NHEJ) opravy než buňky z jiných druhů.
Velrybí fibroblasty také vyřešily dvouvláknové zlomy (DSB) výrazně rychlejší než lidské buňky. Další experimenty tomu nasvědčovaly NHEJ oprava u velryby grónské měla vyšší věrnost než u lidí nebo jiných savců. Tvorba mikrojader po ozáření byla snížena a velké delece byly nejméně časté v buňkách bowhead při endogenním PTEN locus, konzistentní s přesnějším NHEJ a udržení celkové stability genomu.
Zvýšená exprese CIRBP u velryb Bowhead
Srovnání exprese DNA-reparačních proteinů u savců ukázalo vyšší množství katalytické podjednotky DNA-dependentní proteinkinázy (DNA-PKcs), Ku70a Kotě u lidí než u jiných druhů, včetně velryb grónských. Velryba grónská však měla výrazně vyšší množství chladem indukovatelného proteinu vázajícího RNA (CIRBP), který byl u jiných savců z velké části nezjištěn. velryba grónská (bwCIRBP) a člověka CIRBP (hCIRBP) se liší pěti aminokyselinami na C-terminálním konci. Nahrazení těchto aminokyselin hCIRBP s bwCIRBP zbytky zvýšily množství hCIRBPpři nahrazení bwCIRBP zbytky s hCIRBP zbytky to snížily. Autoři to předpokládají CIRBP může podporovat opravu tvorbou ochranných kondenzátů na místech poškození DNA prostřednictvím separace fáze kapalina-kapalina (LLPS).
Funkční role CIRBP při opravách a dlouhé životnosti
Dále nadměrné vyjadřování bwCIRBP v lidských buňkách s integrovanými reportéry zvýšila četnost úspěšných HR a NHEJ opravných událostí a snížil indel sazby. Však, CIRBP delece ve velrybích buňkách významně zvýšila delece a snížila HR a NHEJ účinnost. CIRBP také snížil tvorbu mikrojader a podpořil ochranu konce DNA a věrnost opravy prostřednictvím PAR-závislé interakce. Nakonec nadměrná exprese hCIRBP a bwCIRBP v Drosophila vedlo ke konzistentnímu prodloužení životnosti ve srovnání s kontrolami. Nadměrná exprese také zlepšila přežití po léčbě ionizujícím zářením, přičemž lidské transgeny i transgeny bowhead významně prodloužily životnost v Coxových modelech se smíšenými účinky.
Závěry: Strategie pro dlouhověkost oprav – neeliminace
Fibroblasty velryby grónské vyžadují pro onkogenní transformaci méně mutačních zásahů než lidské protějšky. Nicméně velrybí fibroblasty vykazovaly zesílenou DNA DSB opravná kapacita a věrnost a nižší rychlost mutací než u buněk jiných savců. Navíc, CIRBP byl vysoce exprimován ve velrybích tkáních a fibroblastech. bwCIRBP vylepšené obojí HR a NHEJ opravy v lidských buňkách.
CIRBP nadměrná exprese v Drosophila zvýšená životnost a odolnost proti ozáření. Celkově tato zjištění naznačují, že velryby grónské si zachovávají genomickou integritu spíše než se spoléhat na další geny potlačující nádory, aby zabránily onkogenezi. Tato strategie „opravit – neodstranit“ zdůrazňuje věrnou opravu DNA před apoptotickou clearance a může podpořit výjimečnou dlouhověkost a odolnost tohoto druhu vůči rakovině. Důležité je, že tyto mechanismy jsou zachovány u savců, včetně lidí. Funkční experimenty demonstrující tento luk CIRBP zlepšuje účinnost opravy DNA a snižuje mutagenezi v lidských buňkách naznačuje potenciální translační význam. Vylepšování CIRBP aktivita nebo napodobování jejích strukturálních rysů by mohlo posílit udržování genomu ve stárnoucích lidských tkáních, snížit hromadění mutací a potenciálně oddálit nástup nemocí souvisejících s věkem a rakoviny.
Co mají společného krysa nahá a velryba grónská (dožívá se ~ 200 let) pro vysvětlení jejich pozoruhodné dlouhověkosti?
Vylepšená oprava DNA https://t.co/YqP2E1XePBhttps://t.co/w57FVPj2Cz– Eric Topol (@EricTopol) 29. října 2025